- 1.05 MB
- 2022-05-12 10:03:55 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
Chapter2.有机合成与路线设计基础§1.有机合成要点1.以周期表为依据有机物的构成传统:C,H,O,N,X现代:+B,Si,P,S,As…非金属中心+Metals分支细化:氟有机化学,含氟有机化合物;金属有机化学,含C-M键的有机物(配合物),有机无机杂化,生物有机化学…
2.以羰基化合物为中心醛,酮类有机物,含>C=O,活泼,参与众多反应:--羟醛缩合C链增长--氧化酸--还原醇所以,羰基化合物的反应在有机化学中,处于枢纽地位.3.键的结合方式和键的极性有机键联方式:C-C:C-C,C=C,C≡C…骨架C-非C:C-X,C-OH,C=O……官能团在有机合成中,键联的拆分,键极性的转换…具有重要的意义Hinge铰链
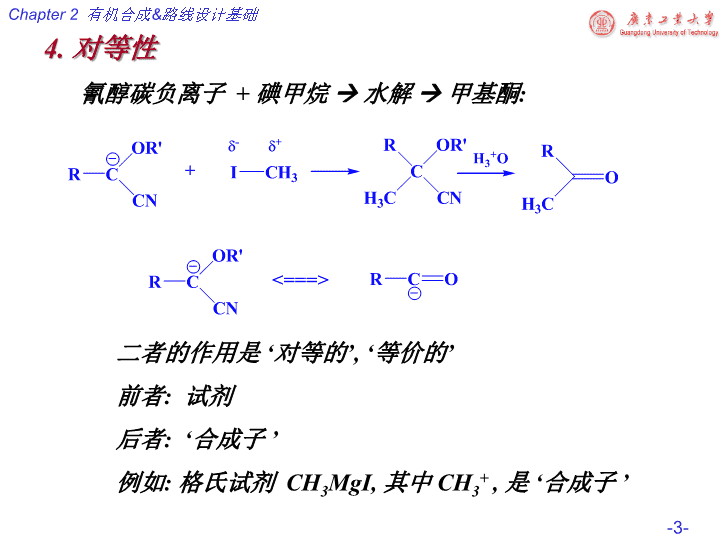
4.对等性氰醇碳负离子+碘甲烷水解甲基酮:二者的作用是‘对等的’,‘等价的’前者:试剂后者:‘合成子’例如:格氏试剂CH3MgI,其中CH3+,是‘合成子’
5.氧化态1)碳的氧化态[Ox](C)=-4:CH4[Ox](C)=-3:CH3-CH3[Ox](C)=-2:CH2=CH2,CH3-OH[Ox](C)=-1:CH≡CH[Ox](C)=-0:CH2=O,CH2Cl2[Ox](C)=+1:CO[Ox](C)=+2:HCO2H[Ox](C)=+3:RO-C≡C-R’,RCOCl,RC≡N[Ox](C)=+4:CO2,(RO)2C=O,ROCONH2
2)氮的氧化态[Ox](N)=-3:NH3,NR3,NHR2,NH2R[Ox](N)=-2:NR2-NR2[Ox](N)=-1:R-CH=CH-R,R2N-OH[Ox](N)=+1:R-N=O[Ox](N)=+3:R-NO2[Ox](N)=+5:HNO33)硫的氧化态[Ox](S)=-2:H2S,R2S,RSH,RCSH,R2C=S,(H2N)2C=S[Ox](S)=-1:R-S-S-R[Ox](S)=0:R2S=O,RSOH[Ox](S)=+2:R2SO2,RSO2H,RSONH2
(1)AppliedCatalysisA:General,2010.Submitted.(2)Chem.Res.ChineseUniv.,2009,26,8.
[Ox](S)=+4:H2SO3,(RO)2S=O,RSO2NH2,RSO2OH[Ox](S)=+6:H2SO4,(RO)2SO44)磷的氧化态[Ox](P)=-3:PH3,PR3,RPH2,R2PH[Ox](P)=-2:PR2-PR2[Ox](P)=-1:R3P=O,R2P(O)H,R2P-OR’[Ox](P)=+1:R2PO2H,R2PO2R[Ox](P)=+3:RPO(OH)2,RPO(OR)2,P(OR)3[Ox](P)=+5:H3PO4,(RO)3P=O
5)硅的氧化态[Ox](Si)=-4:H4Si,R4Si[Ox](Si)=-2:R3SiCl,R3Si-O-SiR3[Ox](Si)=0:R2Si(OH)2,R2SiCl2[Ox](Si)=+2:RSiCl3[Ox](Si)=+4:SiO4,(HO)2Si=O,SiCl46.反应种类根据碳骨架和官能团是否变化,分为4类:1)碳骨架和官能团均无变化
Z、E命名:与双键碳原子所连接的两个优先基团处在双键平面同侧,为(Z)构型,在名称前面冠以Z-.反之,若两个优先基团不在双键平面的同侧,则为E构型,在名称的前面冠以E-.IUPAC命名法,Z是德文Zusammen的字头,指同侧.IUPAC命名法,E是德文Entgegen的字头,指相反.
注意:在(1)式中,优先基团(CH3-和-C2H5)在双键异侧,故为(E)构型,又因为相同基团(CH3-)在双键同侧,也可称为顺式构型。同理,(2)式既是(Z)构型,又可称为反式构型。由此可见,顺、反与Z、E是两种不同的表示烯烃几何构型的方法,在大多数情况下,不存在对应关系。即顺式不一定是Z构型,而反式不一定是E构型。http://sce.scnu.edu.cn/WebCai/organic/CHAP03/3-2/3-2-2.html
2.顺反异构命名:当结合在双键两个碳原子上的两个相同基团在同侧时,为顺式,而在异侧时为反式。把顺(或反)字写在烯烃命名的前面,并用一根短线相连.
只是官能团(双键)的位置发生了变化,分子种类与骨架未变化.2)碳骨架不变,而官能团改变常见芳香化合物的苯环取代基的变化:烯醇酸
3)碳骨架变化,而官能团不变重氮甲烷+羰基物扩环:4)碳骨架和官能团均变化重排:
裂解:蓖麻酸的裂解当然,可采用其它方式,包括取代,氧化-还原(Redox),缩合,环化,聚合….,达到结构的改变.作业:查询g-亚麻酸的分子结构和主要用途.
g-亚麻酸英文名:gamma-Linolenicacid别名:(Z,Z,Z)-6,9,12-Octadecatrienoicacid产品名称:gamma-亚麻酸;全顺式-6,9,12-十八碳三烯酸分子结构:分子式:C18H30O2分子量:278.43CAS登录号:506-26-3附:
Chapter2.有机合成与路线设计基础§2.有机合成路线设计的基本方法合成路线设计的原则与基本方法逆合成法分子简化法官能团置换or消去法分子拆分法1)逆合成法(retrosynthesis)or反合成法(antisynthesis)逆合成法--有机合成路线设计最简单/最有效的方法.
合成步骤:SMABCDTM前进,渐渐复杂化SM:StartingMaterialTM:TargetMaterial合成步骤中,用“”表示每一步合成路线逆合成步骤:TM=>D=>C=>B=>A=>SM后退,渐渐简单化逆合成中,用“=>”表示推断的每一步.要求:①每步有合适和合理的反应机理和合成方法②尽可能简单化,减少反应步骤③原料易得
实例:苯并咪唑酮的逆向合成分析TMBASM即为:SMABTM2)分子简化法将在反应中无变化的官能团简化,找出反应的关键部位:硝化还原加热,环化作业:怎么从苯胺制此SM?乙氧甲酰氨基苯苯氨基甲酸乙酯参见78页
关键:烯的合成.则简化:三取代的乙烯,其中:R=-CH2(CH2)3CH3R’=-Ph醚基羟甲基预合成分子具有明显的对称性,则利用对称性简化:
(CH3CH2)2NCH2CH2NH2+-CO2CH2CH3Infact,TM的中间部分,是以草酸二乙酯CH3CH2O2C-CO2CH2CH3为原料,其中含有两个-CO2CH2CH3∴分子简化法,在某些情况下,与实际合成有出入.3)官能团置换或消去法若反应中,存在多个官能团,且之间有干扰,则采用置换或消去法,之后再设法恢复:
先消去环中双键=>剩余为酮=>进行Micheal反应合成=>达到简化合成目的.下例,TM具有共轭双烯,不好合成=>其中一烯=>转变为羰基=>则易于合成之后,经Wittig反应羰基烯烃:Wittig反应Robinsen环合
4)分子拆分法*TM分子中的极性键拆分两个极性分子.这是逆向合成思维的主要思路之一.同一个分子可采用不同的拆分方法经比较确定最佳合成路线.例如:
注意:①合适的拆开位置②键的极性方向采用的试剂例如,C1/C2拆开可形成-CH2OHor+CH2OH决定选用试剂不同:前者,采用负碳+CH2=O后者,采用正碳+CuCN:
分子拆解中的注意事项:(1)会集法(Convergence):a.将分子拆分两大块拆分次两大块……避免一小块一小块拆分是比较以下2种方法(假设每步产率为80%):甲乙甲:会集法拆分,最后产率为64%;乙:小段拆分,最后产率只有51%
a.对称分子拆分两个相同的大段减少合成步骤达到“简化合成”:(2)在a-碳的位置上拆开:实践检验,此法可行.
(3)在共同碳原子处拆开:共同碳原子(CommonCarbonAtom):多环共用的C原子.在共同碳原子(尤其是桥头C)处拆开复杂多环简单/易合成的结构:a-b间拆开形成简单/对称性双环e-g,f-h间,同时拆开形成简单呋喃环和烯烃
(4)避免大环的合成:8元环以上化合物不易得到,所以拆开时,尽量避免形成大环的合成基.(结合上例)2.合成设计实例例1.昆虫激素Brevicomin的逆合成分析方法1:TM是双环分子,要逐一断开C1-O键:
双环简单线状结构可逆合成思维进行合成.方法2:先断开另一个C1-O双环……2个简单分子:例2.半倍萜Longifolene的逆合成分析TM结构特征:多环:4个,最大的7元环官能团:1个(乙烯基,C5处)方法:C1-C2开环双环再将官能团转换为易合成的化合物:
错误方法:C2-C3开环orC3-C4开环8元环较难合成--
反推究竟到什么地步?----取决于有无合适的原料----取决于有无合适的反应方法§3.有机合成反应的选择性当两个或多个反应途径之间,能量差>12.6kJ.mol-1,则涉及反应的选择性问题.反应的选择性,涉及许多问题不易控制.化学反应要提高转化率和选择性.选择性包括:化学选择性(Chemoselectivity)区域选择性(Regioselectivity)立体选择性(Stereoselectivity)
控制性包括:热力学控制(ThermaldynamicControl)--与产物的稳定性和能量相关动力学控制(KiniticControl)--与反应活化能相关,受电子效应和空间效应影响1.选择性1)化学选择性Chemoselectivityisdecidedbythechemicalactivitytoreflectthedifferentreactivitiesamongthegroups.
对于同一试剂分子中不同基团反应活性差异大好控制分子中相同基团(不同位置)反应活性差异小不好控制位置不同的相同基团,v相差>10倍,则以反应快的基团为主否则,需用基团保护法.NaBH4:选择性还原酮基,对酯基无作用选择性↑LiAlH4:酮基酯基同时还原选择性↓
2)区域选择性定向作用(Oreintation)位置选择性(Regioselectivity)试剂定向进攻反应物某位置得到特定产物试剂活性↓选择性↑例如:活性Cl>Br,选择性Br>Cl利用动力学or热力学(条件)控制产物的优势.----不对称烯烃+HX,加成反应,用不同试剂控制水合不同产物:马氏加成/反马氏加成?
----双烯合成,具有强的方位性:----鲁宾逊反应,也具有很强的方位性:
同一分子中/不同位置/相同官能团反应活性不同:对此多羟基甾(zai)类化合物,MnO2只与3位的烯丙醇基的–OH作用,显示出高的位置选择性.3)立体选择性立体选择性(Stereoselectivity),包括:---非对映异构体选择性(Diastereoselectivity)---对映异构体选择性(enantiostereoselectivity)利用动力学or热力学(条件)控制产物的优势.
立体选择性反应:唯一or主要形成一种立体异构体的反应,叫做~~~~~~.----受位阻/过渡态立体模式/反应条件限制.例如:樟脑酮的LiAlH4还原exa:endo=9:1
生物酶(Enzyme)的立体选择性催化反应:特点:催化能力↑+立体选择性↑非手性化合物催化转化单一手性化合物.体现了立体专一性反应.例:反式-丁烯二酸酶(Fumarase)催化水合加成,将反式丁烯二酸苹果酸:反式-丁烯二酸酶H2O(S)-(-)-苹果酸>99%(R)-(+)-苹果酸<1%
(1)排序:FG大小次序:a>b>c>d上例:-H<-CH2CO2H<-CO2H<-OHdcba(2)按C*-d方向观察,abc顺时针排序R构型abc逆时针排序S构型CIP惯例orR/S结构:观察方向反式-丁烯二酸酶H2O(S)-(-)-苹果酸(R)-(+)-苹果酸HOCO2HCH2CO2HHOCO2HHO2CH2C
D-(+)-甘油醛(R)-甘油醛(R)-a-苯基乳酸(S)-a-碘代乙基磺酸作业:在CIP惯例orR/S结构中,a,b,c,d的排序原则是什么?具体有哪些要求?
答案:当a>b>c>d时,如果由a→b→c是顺时针旋转的,则为R-构型,逆时针旋转则为S-构型问题:ab构型/RS构型LD构型.以上三种构型有什么区别?各自在描述哪些不同的结构时常用?如何判定相对构型?答案:D或L:是分子的绝对构型,是按照Fischer惯例来命名的,按照与参照化合物D-或L-甘油醛的绝对构型的实验
化学关联而指认,常用于氨基酸或糖。D表示右旋,等同于“+”,L表示左旋,等同于“-”.R或S,是分子的绝对构型,是按照CIP惯例来命名的,此种命名方式避免了Fischer惯例的局限性,手性碳上相连的四个原子,把排列次序最小的放在最远的位置,再看其它三个基的排列,如果由大到小是按顺时针方向,则是R型,如果是反时针方向,则是S型.ab构型:三萜,甾体类。当三萜或甾体的结构以通常的方式画在纸上后,只要确定取代基的位置是伸出纸面,还是指向纸内,相连碳的绝对构型就已经确定.实际上确定的是与相连手性碳的绝对构型.习惯上用ab构型来表示,比较方便.
认为第一段有些问题。D-或L-的命名是以甘油醛为标准,将之写成Fischer投影式,如图,不对称碳原子所结合的氢原子的位置在投影式处于主碳链的左边的这种立体结构,称为D-构型,其对映的立体结构为L-型。这样,并不能得出D-与"+"等同的结论。要说等同,这里就要提到d和l。d与(+)同义,为右旋光性的符号;l与(-)同义,左旋。因此,我们可以看到D-(-)-xxxx或D-(+)-xxxx,却不会有d(-)这样的表示。D,L构型与旋光+,-没有关系的。就物理化学性质而言,手性药物对映体之间的区别仅仅是旋光性的不通,其他均无区别,故对映体也称作光学对映体。
能使偏振光的偏振面按顺时针方向旋转的对映体称为右旋体(dextroisonmer)(药名前加(+)或d表示);反之,称作左旋体(levoisomer)(药名前加(-)或l表示)。外消旋体(racemate)(药名前加(±)或dl表示)由等量左旋体和右旋体构成,因此,无旋光性。而内消旋体(mesoform)由于其两个手性中心互相抵消,因此也无旋光性。
手性中心连接的4个取代基按原子序数依次排列,从大到小基团按顺时针方向排列称为R型(右旋体),而按逆时针方向排列者称为S型(左旋体)。手性中心连接的4个取代基按原子序数依次排列,从大到小基团按顺时针方向排列称为R型(右旋体),而按逆时针方向排列者称为S型(左旋体)。必须还有个条件。 就是最小的基团位于观测者的对面。这是很重要的,不然会混淆R,SR型与S型是从构型方面来划分,R型不一定就是旋光右旋(右旋旋体),即D型,S型不一定就是旋光左旋(左旋体),即L型。d/l表示右旋和左旋R/S是绝对构型的表示方法D/L是相对构型的表示方法,多用于糖类和氨基酸d/l表示右旋/左旋体或旋光方向R/S是按次序规则对绝对构型的一种表达区别的标记
合成手性试剂的应用:手性氢化铝锂还原非手性1-苯基丁酮(-)-1-苯基丁醇(100%,无对映体形成,属于高度立体专一性反应)1-苯基丁酮手性氢化铝锂(S)-(-)-1-苯基丁醇(100%)
对映过量(enatiometricexcess,ee%):立体化学中,用对映过量(ee%),来表示对映异构体的纯度.若反应产物中,对映异构体的比例为92:8,则ee%=92–8=84(%)前例酶催化反应中,(S)-(-)-苹果酸的ee%接近于99%后一例合成手性氢化铝锂还原反应中,(-)-1-苯基丁醇的ee%=100%,属于完全立体专一性反应.
2.反应的控制因素反应有多途径进行时,有两种因素,可控制反应进行方向.其一,是产物稳定性热力学控制因素—可能性因素其二,是反应速率动力学控制因素---现实性因素热力学控制的反应:2-庚酮+乙醇钠取代烯烃(属于加成+消除?):
产物分布:由于三取代烯烃A的稳定性>二取代的B,∴A为主要产物(在消除过程中,由热力学稳定性所决定的!)动力学控制的反应:2-庚酮+三苯基锂--THF取代烯烃(属于什么反应?):产物分布:取代少的不稳定的B’>取代多的稳定的A’,属于典型的动力学控制过程.
动力学控制过程,主要受电子效应和空间效应的影响.试比较下例:(1)中,-OH给e的协同作用同侧加成环氧与-OH同侧(2)中,酯基拉e+空间阻碍异侧加成环氧与酯基异侧(1)(2)
Chapter2作业:1.在以下逆向合成中,将TM可拆成不同碎片:(1)(2)(3)(4)
其中(1)和(2)可利用讲义中合成方法,还原得到TM.a.试查出(3)和(4)的具体还原合成法.b.找出(1)的合成中烯烃负碳离子的等价物(原料).2.如何以苯为原料,合成PhNHCOOEt()?并最终合成得到苯并咪唑酮()?详细写明各步反应条件.
X3.化合物的逆合成分析,可在a-b,a-d和b-c之间开环.画出各处开环的产物.哪种开环分析合理?为什么?4.总结本教案提及的人名反应机理,给出特例.5.总结有机合成路线设计的规律.6.在CIP惯例orR/S结构中,a,b,c,d的排序原则是什么?具体有哪些要求?7.ee%是什么含义?若反应产物中,对映异构体的比例为83:17,计算ee%值.
8.查询手性异构体联萘酚or联萘胺的合成分离与手性异构体的拆分(合成反应,分离提纯方法,手性异构体的拆分方法).
您可能关注的文档
- 公路路线设计规范JTG D20—2006
- 景观理念在高速公路路线设计中的体现
- 道路勘测设计课程设计--《公路路线设计》(纸上定线)
- 校园垃圾清运路线设计说明书
- 基于纬地道路8.0的道路工程路线设计
- 《重庆市--城市道路交通规划及路线设计规范》-文本12.06日版
- 河北红色旅游“五大品牌”的景观路线设计与市场开发调研
- 校园清运路线设计
- 给二级公路组学生路线设计说明书
- SS28二氮杂双环430壬烷新路线设计及关键中间体的合成
- 数字地面模型DTM和CAD技术在公路路线设计中的应用和发展
- 路线设计与景观设计相结合之探讨
- 公路路线设计规范(JTGD202017)
- 《海南旅游路线设计》PPT课件
- 旅行社路线设计(1).doc
- JTG D20-2006公路路线设计规范
- JTG D20-2017 公路路线设计规范 - 完整
- 导套加工工艺路线设计说明书