- 3.54 MB
- 2022-05-12 10:03:59 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
第6章逆合成分析法与合成路线设计20世纪60年代,Corey在总结前人和他自己成功合成多种复杂有机分子的基础上,提出了合成路线设计及逻辑推理方法。创立了由合成目标逆推到合成用起始原料的方法一逆合成分析法。该方法现在已成为合成有机化合物特别是对复杂分子的合成具有独特体系的有效方法。6.1逆合成分析法[切6.1.1逆合成分析法概念有机合成是利用一种或数种结构较简单的原料经一步或数步有机化学反应得到既定目标产物的过程。这一过程可用如下表示反崗反应原料—一中间物——--_-目标分子(产物)逆合成分析法是将合成目标经过多种逆合成操作转变成结构简单的前体,再将前体按同样方法进行简化,反复进行直到得出与市售原料相同结构为止。其整个过程可表示如下目标分子“能時另外的冃标分了仝合成转变>前体(合成子)逆介成钱变:〉前体的前体-……原料对于结构复杂的化合物,可能有多个前体及多个前体的前体,因此产生多条逆合成路线(图6-1)目标分子图6-1多路线逆合成分析示意图图中A、B、C可以是目标分子的一级前体或另外的目标结构,E、F、G等为二级前体,其余类推。
根据Corey的定义:合成子是指分子中可由相应的合成操作主成该分子或用反向操作使其降解的结构单元。一个合成子可以大到接近整个分子,也可以小到只含一个氢原子。分子的合成子数量和种类越多,问题就越复朵。例如C6H5COCHCOOCH3(a)C6H5(b)C6H5CO(c)COOCH3(d)C6H5COCHCOOCH3CH2CH2COOCH3:>(e)CH2CH2COOCH3⑴CH3OCOCH2(g)OCH3ch2CHCOOCHj在这些结构单元中,只有(d)和(e)是有效的,叫有效合成子。因为(d)可以修饰为C6H5COCHCOOCH3,(e)可以修饰为CH2=CH2COOCH3o识别这些有效合成子是特别重要的,因其与分子骨架的形成有直接关系。而识别的依据是有关合成的知识和反应,也就是说有效合成子的产生必须以某种合成的知识和反应为依据。亲电体和亲核体相互作用可以形成碳-碳键,碳-杂原子键及环状结构等,从而建立起分子骨架。例如:—C-M+x-c——C-MgX+>°COOEt0[^y^COOEt若把上述反应中的亲电、亲核体提出来,上述反应便简化为:+o-ct^0[^y>-COOEt
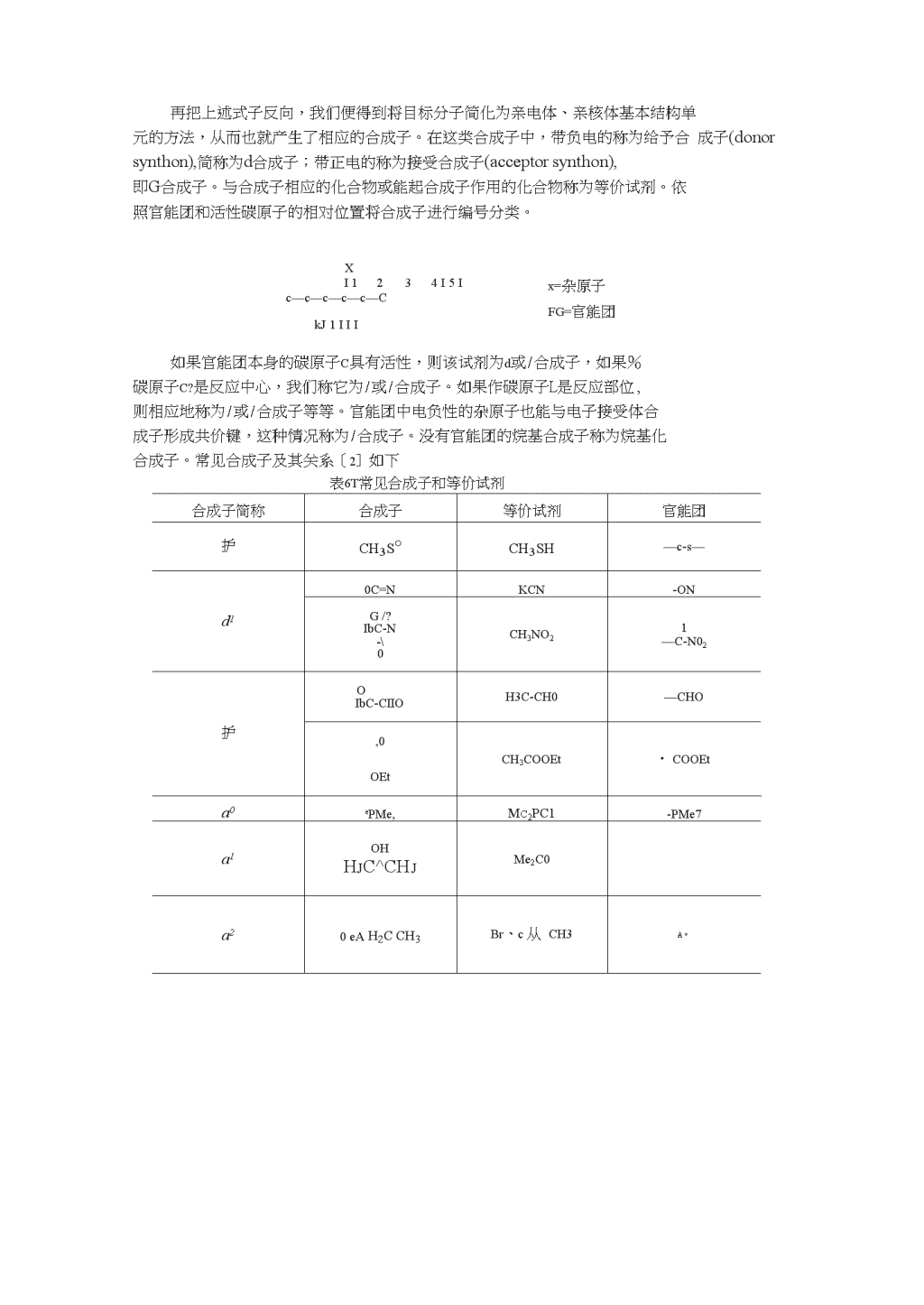
再把上述式子反向,我们便得到将目标分子简化为亲电体、亲核体基本结构单元的方法,从而也就产生了相应的合成子。在这类合成子中,带负电的称为给予合成子(donorsynthon),简称为d合成子;带正电的称为接受合成子(acceptorsynthon),即G合成子。与合成子相应的化合物或能起合成子作用的化合物称为等价试剂。依照官能团和活性碳原子的相对位置将合成子进行编号分类。Xx=杂原子FG=官能团I1234I5Ic—c—c—c—c—CkJ1III如果官能团本身的碳原子C具有活性,则该试剂为d或/合成子,如果%碳原子C?是反应中心,我们称它为/或/合成子。如果作碳原子L是反应部位,则相应地称为/或/合成子等等。官能团中电负性的杂原子也能与电子接受体合成子形成共价键,这种情况称为/合成子。没有官能团的烷基合成子称为烷基化合成子。常见合成子及其关系〔2]如下表6T常见合成子和等价试剂合成子简称合成子等价试剂官能团护ch3s°ch3sh—c-s—d10C=NKCN-ONG/?IbC-N-�CH3NO21—C-N02护OIbC-CIIOH3C-CH0—CHO,0OEtCH3COOEt・COOEta0ePMe,Mc2PC1-PMe7a1OHHjC^CHjMe2C0a20eAh2cch3Br、c从CH3A。
◎表6-2a和〃合成子转换转换类型化学反应dd(交换杂原子)zBr+ph*_HBr(垃㊉(。汽——⑷/CPPh3W+Mg或十2M«)/X—而一-/C-MgX,/C-M(或+HS(CH2)3翌贽QSdd(加成)0G0HII+CNJleAr^G/J^cN^->cf(取代)构建分子骨架除了亲电体和亲核体相互作用之外,还有自由基反应和协同反应,它们生成的产物可依据各自的反应拆开成相应的自由基合成子(八合成子)和电屮性非自由基合成子(◎合成子)。表6-3e合成子合成子简称合成子反应与试剂R・2RC00-—2RC00"?•2R-R_RRCOOR1RRR2RC00R*RCOOR*蟲・)=(Hz°>R-C-C^NaOONaoh"。eC.HC1IIA02.合成子产生的基本方法⑶
逆合成转变是产生合成子的基本方法。这一方法是将目标分子通过一系列转变操作加以简化,每一步逆合成转变都要求分子中存在一种关键性的子结构单元,只有这种结构单元存在或可以产生这种子结构时,才能有效地使分子简化,Corey将这种结构称为逆合成子(retron)0例如,当进行醇醛转变吋要求分子中含有.C(OH).C-CO-子结构,下面是一个逆醇醛转变的具体实例:醇醛转变醇醛反应I上式中的双箭头表示逆合成转变,和化学反应中的单箭头含义不同。常用的逆合成转变法是切断法(disconnection缩写dis)。它是将目标分子简化最基本的方法。切断后的碎片便成了各种合成子或等价试剂。究竟怎样切断,切断成何种合成子,则要根据化合物的结构,可能形成此键的化学反应以及合成路线的可行性来决定。一个合理的切断应以相应地合成反应为依据,否则,这种切断就不是有效切断。逆合成分析法涉及如下基本知识。表6-4逆合成切断变换类型目标分子合成子试剂和反应条件一基团切断(异裂)0H5】%曲。TH+光r+*EtMgBrJ(")C2H5S>(chsch-^-ch2choI"・OHOHCH3CH+-……*CH^CIIO"CH2CHO……*CH:CHOch3ch3【例5】对H3C—C—Cx分析ch3Xoch3ch3:〉H,C——C——C——CH,IIOHOH+II注意频哪醇重排前后结构的变化:/—c—c-IIOHOH合成就可以解决2O2O3)加入基团帮助切断有些冃标分子要加入某些基团(或官能团)才能切断,从而找出正确的合成路线。例如【例6】对分析这是一个惰性的目标分子,当在环己基中引入轻基后,便可进行下一步的切断
在进行逆合成转变时,可以省去亲核体和亲电体过程,对逆合成转变进一步简化。【例7】对ch3分析从而使得便于切断:COOH合成
CH无水AIC】3ch3还原CH3【例8】对〉=/一Ph分析在冃标分子小引入疑基帮助切断:0H(无OH生成)因此,选用V再做如卜.切断:0HphOHphMiBr合成BrPh①Mg,Eg②McqCO③比0Ph-h2QPh【例9】对H3ONO分析在目标分子中引入酯基帮助切断。例如,N-甲基哌呢酮的切断
H3C-NCO2Et^^CO^Et0>H3C-N尸OH3C-》/COgEt>CH3NH2+RCHO+HC^CH+RfCHO4)在杂原子两侧切断碳原子与杂原子形成的键是极性共价键,一般可山亲电体和亲核体之间的反应形成,对分子框架的建立及官能团的引入也可起指导作用,所以目标分子中有杂原子时,可考虑选用这一策略。例如:【例11】对o—CH2CH2CH2CH=CH2分析O|-CII2CIl2CII2CH=CII2+Br—ClbCIbCIbCII^CIb【例12】对I分析丁烯二醇必须具有顺式构型,方可进一步切断:HOHO?2IICIIO+H-C三C-H合成H—OC—HNa.液氨,皿22叫Na_c^c_Na2HCWHOHO氏,Pd/£HOBaSOqHO
CH,【例13】对《y—och2chch3-hci分析^ch3nh2CII3ch3OCH2CHCH3*HC1Inii2o-^-ch2chch3ch3缶ch3OCH2CCH311,NOH13ch3ch3oh+ch2-chch3Vch3O-|-CH2CCH3oCH311ch3OH+C1CH2CCH3IIoch3合成有以卜•两种方法:方法一此法较成熟,但氯丙酮为催泪剂,操作不方便。方法二
目标物1-(2,6-二甲苯氧基)界丙胺盐酸盐是一种抗心律失常用药。N(CH2CH2CH3)2【例14】对o2NnfjTN°2(取代芳胺)分析CFsN(CH2CH2CH3)2%A/W»no2FGI+HN(CH2CH2CH3)2NO2ClCF3ClCF3冃标分子屮苯坏上有三个吸电子基团,其氨基可由卤代苯的亲核取代反应引入。在对氯三氟甲基苯中氯原子是第一类定位基,三氟甲基是强间位定位基,硝基对顺利引入既定位置。经卤素交换反应可将-CC13转变为CF3,而CC13可以从・CH3的彻底卤代得到。甲基和三氯甲基是两类不同性质的定位基,因此要在甲基陛段引入对位氯原子。合成
hno3no2h2so4苯环侧链氯代是自由基反应。5)围绕官能团处切断,这是分子最活跃的地方。合成
、"0(DMg,Et2O(2XO2③H2O29+106)变不对称分子为对称分子某些冃标分子表面看起来是不对称的,实际上是潜在的对称分子。例如:
(CH3)2CHCH2CCH2CH2CH(CH3)2=>(CH3)2CHCH2-$C三C-$CH2CII(CI【3)2^=>—c三c—+2CH2CH(CH3)2Br因为9H2?h—c-c_~—C=C11——c=c—+non合成ONaNH2/(CH3)2CHCH2BrH—CX—H,2NaNH;,CH?);CHCH;Br(CH3)2CHCH2—C=C-CH2CH(CH3)2oII(CH3)?CHCH2CCH9CH2CH(CH3)97)利用分子的对称性进行切断-•些目标分子常常含有一定的对称因素,如对称面、对称中心等。在逆合成分析过程屮,注意利用这些因素可以使问题简化。如对颠茄酮的合成,考虑其对称因素,在对其进行逆合成分析时成对地切断一些对称键,可得如下结果:COOHCHOH〈+N—Me+c=oXHOHZ〈COOH这正是Robinson的合成方法。Corey在合成番木瓜碱时就利用了这一策略。番木瓜碱是一种具有药理活性的大环内酯类生物碱,利用其分子的对称性切断后得到两个完全相同的前体一番木瓜酸由番木瓜酸合成番木瓜碱是很方便的,成对切断示意如下番木瓜碱》2(CH2)7COOH番木瓜酸鹰爪豆碱的分子也具有对称性,如果在中心的亚甲基上引入拨基,然后在两侧对称地利用反Mannich切断,便可将分子高度简化,反应过程表示如下⑹
这样便推出了三种基本原料:哌唏、甲醛和丙酮,其合成反应都是经典的标准(Standard)反应,一般是容易实现的。从表面上看,普梅雷尔酮(Pummerer"sKetone)分子屮并不存在对称因索,但经切断后得到的两个自由基皆出自同一前体:Corey将其称为潜对称因素⑺。2.几种重要类型目标化合物的简化1)卩-疑基琰基化合物和a,卩-不饱和化合物的切断B■瓮基按基化合物可用醇醛型缩合反应来制备。只要我们注意其形成前后分子结构的变化,就可以得出切断的方法。CH3CHO+CH3CHO卩ach3ch-ch2choOH凡卩-轻基醛酮切断有如下规律:1)切断a,卩键;2)切断卩-C上的氧-氢键,OH中的氢变为a-C±的氢;3)卩-C和它上的OH中的氧变为拨基。例如ch3ch2okaX/VH一c^—0—a-■kAAAX.23HPCCHOI>CH3CII2CIICII3+CH?O
o卩-疑基醛或酮易于脱水而成(I,卩-不饱和醛或酮。这种易于脱水的特性,是与P-疑基醛或酮分子屮a-氢原子具有活泼性,以及脱水后形成兀一兀共轨体系密切相关。据此,对%卩-不饱和拨基化合物可以如此切断:CHO-Ica=对这类化合物有如下切断规律:上变为拨基。例如:1)切断匕卩—烯键;2)a-C上加两个氢;3)B-C卩=CHCOCH^-CHC6H5+ch3choc6h5ch二?2C6H5CHO+CH3COCH3chco2h+h2o+co2合成:2C6H5CHO+CH3COCH3"鳥;咒:°亠"AC6H5CH=CHCOCII=CHC6H5+2H2O
断。Y-和§-羟基酸受热易脱水形成内酯:OH0HRCHCH2CH2COh2c-ch2R-HC、0/Cio+h2o丫■内酯OHOHIIRCHCH2CH2CH2CO"酸h2/C、h2cxch2-R-HC、O,C+h2o&内酯当厂或§-疑基酸的钠盐酸化时会白动形成内酯,特别是前者。当内酯与过量强碱回流时,就转变为酸的碱金属盐。h2c-ch2dxHC/C^o+NaOH►RCHOHCH^CH^COONaKO__据此,对上述内酯就有切断的办法了:【例19】oOHtOOH>ohc^?^oh+CH3CO2HohZ+ch2o合成CH2OK2CO3OHC乂‘OHH2C(CO2H)20HCNH3,C2H5OHJOO°C,r环化和脱竣自动发生。1)1,3-二拨基化合物的切断1,3-二拨基化合物的制备,通常是用克莱森(Claisen)缩合反应。根据该缩合反应的特点,可以做如下切断。旳sH=^>2CH3CH2CO2C2H5【例20】h3c-c-co-rc—CO2C2H5ch3酯分子内缩合叫狄克曼(Dieckmann)环化。
【例21】ch3oCO2C2H5co2c2h5co2c2h5不同酯间的缩合产物同样能够用切断法对分子简化。例如【例22]a/CO2C2H5co2c2H5h3c-|-ch/CO2C2H5>CH3Br+~H2C【例23】切断a法Ph—CII合成CO2C2H5co2c2h5/CO2C2H5H3c—CHhco2c2h5>CH3CH2CO2C2H5+co2c2h5co2c2h5co2c9h5/Ph—CH才bCO2C2H5PO2C2H5CO2C2H5PhCH2CO2CoH5+/°2。2出co2c2h5gcg+翳;—COCO2C2H5C6H5CHCO2C2H5+C2H5OH+COco2c2h580%〜85%切断b法
/CO2C2H5Ph一CHOII>PhCH2CO2C2H5+C2HsO—C—OC2H5CO2C2H5合成zco2c2h5PhCH2CO2C2H5+C2H5O—C—OC2U5Ph—CH+C2H5OHco2c2h586%C2H5O2CCO2C2H5CO2C2H5【例25】最初从華木植物白屈菜中分离出來的H屈菜酸切断OoHO2COho2choohco2h>CH3COCH3+ho2cOH+HO2COHc2h5o2c【例24】r^oc2h5o2c4,5■二氧代环戊烷一13二竣酸二乙酯co2c2h5>+CO2C2H5合成:丙酮不能与草酸缩合,但草酸二乙酯却能与丙酮发生Claisen反应,反应如下
oc2h5C2II5O2C人o+OC9H5丄"C2H5ONaC2H5O2C3•中基色酮O八CO2C2H5切断*HCO2EtMe+HCO2EtMe+H2O1)1,5-二拨基化合物的切断Michael缩合,也称Michael反应,是合成1,5-二拨基化合物的重耍反应,是含有活泼氢化合物在%卩-不饱和拨基化合物上的共觇加成反应。可用通式表示如下-c=c-c=o+H—C—共辘加成—c—c=c—OH—C———c—CH—C=OI—c—I加成物
从缩合前后分子结构的变化可以看出,1,5-二拨基化合物可以在两个不同的部位切断:PhPh>°十CH3CHO+CHO这样对1,5-二拨基化合物就有通常的切断办法了。5-二甲基-1,3-环己二酮【例27】合成5,H3C、H3L切断H3C1JOo怜7IIjCCH3JO、nEtO>ch3cooc2h5合成切断H$C丫行CHCII3O3cooc2h5+cooc2h5(10-甲基・9-"「六氢-2-蔡酮)ch3
合成1,4-二苯基-2,6-二氧代哌噪-3-竣酸乙酯。Ph广厂CO2C2H50人"1%Ph【例29】合成o切断PhPh4CO2C2H5r%>II5C2O2Cco2c2h5Phr+②⑧⑨(不适用)由冃标分子通过官能团的系统变化(PGT,FGA,FGR)转换为“替代冃标分子”,而这些替代的目标分子往往更易合成⑵。为了使目标分子更有效地简化,有时可能需耍儿种转换方法同时应用。例如⑵6-軽基-3-甲基己酸甲酯是1,6-双官能团目标分子。虽然它的前体是环己烯和环己二烯衍生物。另一个可能的原料是香茅醛,它是容易从白然界得到的一种天然产物。
6.2合成路线设计借助逆合成分析,对下列冃标分子进行合成路线设计。6.2.1合成路线设计实例【例34】试对镇痛药度冷丁作切断分析,并设计合成路线PhCO2EtVCHH
切断
合成ClCIUCIhOIINaOHNIch3PJCNHO$H2NCH3FGI2AIH2NCH3‘OHNCH3PhCN||H+JbOPhCO2H[]EtOHPhCO2Htn〈N丿H2SO47丿1ch31CH31CH3HC1EtOH【例35】试对下面多烯化合物作切断分析,I+ch3SOC1?ch3PhCH^CN■NaNH2并设计合成路线
目标分子有畚个双键,切断中间的双键把分子分为大小差不多的两部分。进一步转变或切断就容易了。合成++【例36]子试对下面稠环化合物作切断分析,并设计合成路线O
ONaNH26OCH3①CH3COC1②PC13「③碱其中烘键的形成过程为:碱-2HC1【例37】试对下面桥环化合物作切断分析,并设计合成路线CO2EtCO2Et
【例38]试对2-茉莉酮作切断分析,并设计合成路线2-茉莉酮是一个oc,旷不饱和环戊酮,钏链上带有一个五碳的顺式烯烧和一个甲基,有多种切断和多种合成路线。切断一Br切断二OH合成二
切断三()HSSH+OHHO.Br在冃标物简化中,对1,4-二酮拨基采用硫代缩酮保护以改变其极性。合成三①n・C4H°Li②CHJ①n-CHLi②【例39】试对非當体雌激素己烯酚作切断分析,并设计合在路线切断一OMe
切断二合成二
还可以有其它参考合成路线。从上述切断分析和路线设计,对以进一步感受到,熟悉易得的起始原料和熟悉有机合成反应,对于切断分析和合成路线设计都是十分重要的,对于掌据逆合成分析法更是不言而喻。6.2.2复杂化合物合成设计实例1.卩-紫罗酮⑴紫罗酮是一类天然香料的总称,可从指甲花属、广木香等植物提取液中分离得到。|3-紫罗酮(八匚双键)是英中主要成分之一。对(3-紫罗酮的逆合成分析主要有两条路线:++HC=CHO路线(I)是通过逆Diels-Alder转变将冃标分子中的六玩环切断为双烯体和亲双烯体而进行简化的路线;路线(TI)采用了分子内亲电加成成环及分子内[3,3]&移位重排的逆向转化最终简化为普通原料。虽然路线(I)简短,但由于本例的双烯合成反应收率很低而无实用价值,路线(TT)尽管较长也较复杂,但由于采川了分子内反应,使收率明显提高而具有实用性。其合成主要步骤如下:1)6-甲基-5-庚烯-2-酮的合成
77%此化合物也可以通过逆醇醛缩合反应自oc,"CHO匕03,址0卩-不饱和醛制备+CH3CHO2)3,7-二甲基-6-辛烯-1-烘-3-醇(芳樟醇)的合成0HC三CH,NaNH?H082%3)芳樟醇乙酰乙酸酯的合成O30°CONaOH100%5)卩-紫罗酮的合成63%A1(OPM)3,[3,3]5移位重排H2SO473%1.(1S,2R,4S,5R)-5-乙基2,4-二甲基-6,8-二氧杂双环[3.2.1]辛烷(a-多纹素,a_Mu11istriatin)的合成⑴or多纹素是榆树害虫一小蠹虫的聚集信息素,合成这一信息素是为了寻找一种控制害虫而又不伤害有益昆虫的方法。or多纹素是一种双环缩酮,其逆合成分析和合成步骤如下:切断
合成(或)HOH2CLiAlH76%NHj+EtMgBr64%()84%O()53%(几种异构体的混合物)OCH2OSO2CH2H+ClsoHOOCNMgBr42%86%CO3H6.2.3合成路线的评价
冃标物的合成可能会有多种合成路线,其可行性及优劣可根据下列原则进行评价。1.总体考查应当考虑是否符合原子经济学说和环境友好,在该前提下,尽可能釆用收敛式合成路线。下面表示由原料A经不同路线得到产物G进行分析:(1)A_——D―E—F―G(2)A—CD—E—Fz(1)为直线型合成路线,经6步反应得到产物,假如每步反应的收率为90%,则总收率为54%。(2)为收敛型合成路线,其总收率为73%。可见收敛型路线比直线型优越。合成路线一般是越短越好,最好是一步完成。即便是由多步构成的合成路线,最好不将中间体分离出來,在同一反应器中连续进行,这就是逐渐引起人们重视的"一锅合成法”(one-potsynthesis)02.原料价廉易得原料价廉易得是选合成路线的重要依据O1.反应的选择性应当采用反应选择性好的合成路线,一般副反应少的路线收率相应也高,三废量也会减少。2.反应条件温和或易于控制反应条件包括溶剂的选择、温度的高低和控制、加热方式、压力、催化剂的选择、作用物比及作用物添加顺序等。3.整个过程的安全性合成过程中所用原料或溶剂是否易燃易爆,反应是否急剧放热,作用物有无腐蚀性和毒性等都应作详细调查,路线确定后,对每种危险因素应有相应的防范措施。
诚然,全部符合上述条件的合成路线是非常难得的,这些条件只能是相对的。但我们应当积极朝着这些方面去努力工作。参考文献1徐家业主编.有机合成化学及近代技术(第-•版)•西安:西北工业大学岀版社,19972[联邦徳国]J.富尔赫林,G彭茨林合著.韩长月,杜建新,宋小平译.冇机合成,北京:化学工业出版社,19903CoreyEJ.Agew.Chem.Int.Ed.Engl.1991,30(5):4554嵇耀武.有机物合成路线设计技巧.北京:科学技术出版社,19845CoreyEJ.NicolaouKGetal.J.Am.Chem.Soc.,1975,97:6546张滂.冇机合成进展.北京:科学了版社,19927CoreyEJ.PureAppl.Chem.1967,14:19
6-1完成下列化合物的逆合成转变O⑴CH?h3cohOHC6115C1I=chcocii=chc6ii5Pl—°(5)⑺6-2借助逆合成分析法合成下列化合物(1)⑵EtIN、Et
参考答案6-1(1)分析:合成:⑵分析:合成:](3)分析:合成:(4)分析:合成:CO2CII3PhCII2O"CHiCO2CH3IIOCHnCIbOH■■+2CH3MgICH3MglNa•液氨.CH2OHO、』一C6H5CH=CHCOCH=CHC6H52C6H5CHO+CH3COCH3CO.Et厶CO.EtPh+PhBr—HII2+HPh-/812C6H5CHO+CU3COCH310%Na()H2()25吃.C6H5CH=CHCOCH=CHC6H5CO.EtICO,ElCO2Et?O2EtEtONa-EtOH
(7)分析:Bi—CH2-j3=CH2hBrBrCH2-yHCH2BrBr合成:Br—CH2-CH=CH2Br?,CCSVCBrCH2-^HCH2BrBrNaO—Br-CH2fCH?BrC6HnMgBr
o+ch2oOHNO》NH.Q)NaNO2,HCI②出0NO.①HN6-II2SO4②II2/Pd-C③Ac?。6-2(1)分析Br合成①HNO3川jSOj(gSnJICl分析II3CH3C合成NHAc①Bt>HOAc②NaOHFGNhac弊仝②比0/屮
(3)分析H2N合成①Nag/HCl②Cu(I)CNh2N‘1EtFGINaCr2O7H2SO4h2n(4)分析COOHHjCOCHNNHCOCH3合成(5)分析NaOIIH2OFGINIILtH.IEteg。、11oo2nonHOCH
您可能关注的文档
- 关于道路路线设计若干问题浅析
- 对党的群众路线设计教育活动认识
- 《金属材料与热处理》典型零件的选材原则和工艺路线设计说明书
- 公路路线设计规范试卷
- 基于某纬地道路8.0地道路工程路线设计
- 最佳旅行路线设计(值得细读),图论
- 路线设计及调研 翻译
- JTGD20-2006公路路线设计规范高清
- 导套加工工艺路线设计
- 仓储与配送管理第六章配送运输路线设计
- '安徽心之旅杯'大学生旅游路线设计大赛策划书
- Corey 有机合成路线设计的五大策略
- 2017届高三化学一轮复习学案:有机化学基础第12讲有机物合成路线设计
- 九寨黄龙旅游路线设计-Z
- 公路路线设计说明
- 武当山旅游路线设计PPTPPT
- 有机合成路线设计的技巧
- 路线设计任务书